Het laden van een batterij
Bij de uitdrukking "laden van een batterij" moet men niet denken, dat de elektriciteit, die de batterij binnenkomt, daarin wordt opgespaard, om er later, wanneer men de batterij als stroombron gebruikt, weer uit te komen. In werkelijkheid wordt de oorspronkelijke elektro- chemische toestand van de platen en van het elektroliet hersteld. De batterij kan dan weer stroom leveren. Het laden van een batterij is daarom beter te vergelijken met het opwinden van een veer in een klok dan met het toevoeren en opslaan van elektrische energie.
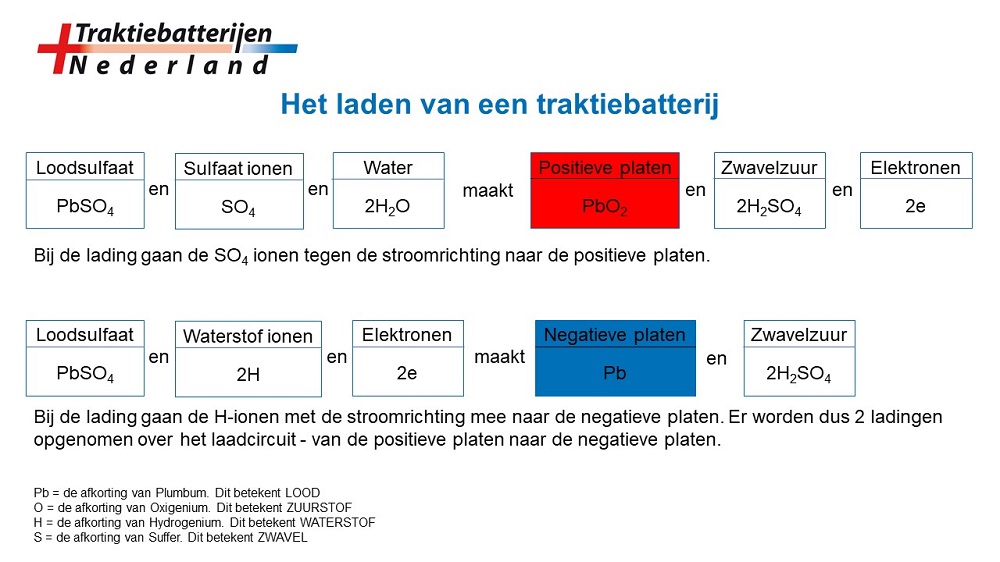
Het is belangrijk om te beseffen, dat bij het laden van een batterij slechts de uitgangspositie van platen en elektroliet wordt hersteld, door het toevoeren van elektronen aan de negatieve platen. Een deel van de elektronenstroom komt rechtstreeks uit de lader en een deel vloeit vanaf het positieve platenpakket over het ladercircuit terug naar het negatieve platen pakket. Hierdoor zullen de waterstof ionen (2H) naar de negatieve platen stromen, om daar met het aanwezige loodsulfaat (PbSO4) te reageren naar sponslood (Pb) van de negatieve plaat, en zwavelzuur (H2SO4).
Bij de lading gaan de sulfaat ionen tegen de (elektronen) stroomrichting in naar de positieve platen om daar met het water en met het loodsulfaat te reageren tot looddioxide van de positieve plaat (PbO2). Hierbij wordt zwavelzuur (H2SO4) gevormd en er komen elektronen vrij die over het uitwendige circuit, in dit geval de lader, naar de negatieve platen worden afgevoerd. Het in de porien van de platen gevormde zwavelzuur moet zich uitvlakken met het uitwendige, dunnere zuur tussen de platen. De porien openen zich weer en de inwendige weerstand neemt af.
Ook bij het laden treedt een Ohm's spanningsverlies op dat in dit geval echter spannings verhogend werkt, omdat de stroom in tegengestelde richting als bij de ontlading vloeit. De klemspanning wordt hierdoor U = E + I.Ri en neemt meteen na het inschakelen toe, omdat het stijgen van het sg van het zuur in de platenporien bij het laden zorgt voor een gestadige stijging van de EMK (E). De spanningsterugval ten gevolge van de afname van de Ohmse weerstand in de cel tijdens het laden is hier tegenover te verwaarlozen.
Bereikt de klemspanning een waarde van ca. 2,4 V / cel dan is (als de laadstroom niet extreem hoog is) het grootste deel van het loodsulfaat in respectievelijk lood (negatieve platen en loodoxide (positieve platen) omgezet. Hierover meer bij de beschrijving van de verschillende laadkarakteristieken.
Bij deze zogenaamde gasspanning zet waterontleding (knalgas vorming) in omdat de toegevoerde stroom niet meer zonder meer voor de chemische omzetting van de actieve massa kan worden gebruikt.
Het water wordt hierbij gesplitst in zuurstof (gas), en waterstof (gas). Dit waterstofgas H2, omhult de platen en werkt als een isolator voor verder elektrisch energietransport. De stroomdoorgang komt hierdoor tot stilstand. Dit verschijnsel heet "polarisatie". De spanning stijgt hierbij snel door de aan de negatieve platen optredende waterstof overspanning, tot een meer constantere waarde die wordt bepaald door stroomsterkte, constructie van de cellen, ouderdom en temperatuur van de batterij.
Wilt u meer weten of heeft u een specifieke vraag voor uw eigen situatie?
Neem contact met ons op:
073 - 633 0750 of mail ons via ons contactformulier.
Onze experts staan voor u klaar.
